Analiza białek jest szczególnie istotna w wielu branżach i zastosowaniach. Białka, zwane również polipeptydami, to związki organiczne złożone z aminokwasów. Są podstawowymi jednostkami budującymi organizmy żywe, które uczestniczą w praktycznie każdym biologicznym procesie. Analiza oddziaływań między białkami jest kluczowa m.in. w projektowaniu i produkcji leków.
Białka różnią się między sobą w zależności od rodzaju, liczby i sekwencji aminokwasów, które tworzą szkielet polipeptydu. Odmienne struktury molekularne wpływają bezpośrednio na właściwości fizykochemiczne protein. Analiza białek w niniejszym artykule została opisana na podstawie kilku wybranych metod i technik badawczych.
1. Techniki separacji i wyznaczania masy cząsteczkowej
Jedną z podstawowych technik służących do charakteryzacji białek jest chromatografia wykluczania GPC/SEC. W metodzie tej roztwór białka przepuszczany jest przez wypełnioną porowatym żelem kolumnę, a poszczególne cząstki dyfundują do i z porów. Separacja oparta jest o wielkość cząsteczek – większe cząsteczki szybciej opuszczają kolumnę i trafiają do detektora jako pierwsze. Połączenie chromatografu żelowego z zaawansowanymi detektorami pozwala na pełną charakteryzację białek i polimerów pod względem rozkładu masy cząsteczkowej, stopnia zagregowania czy też konformacji cząsteczek.
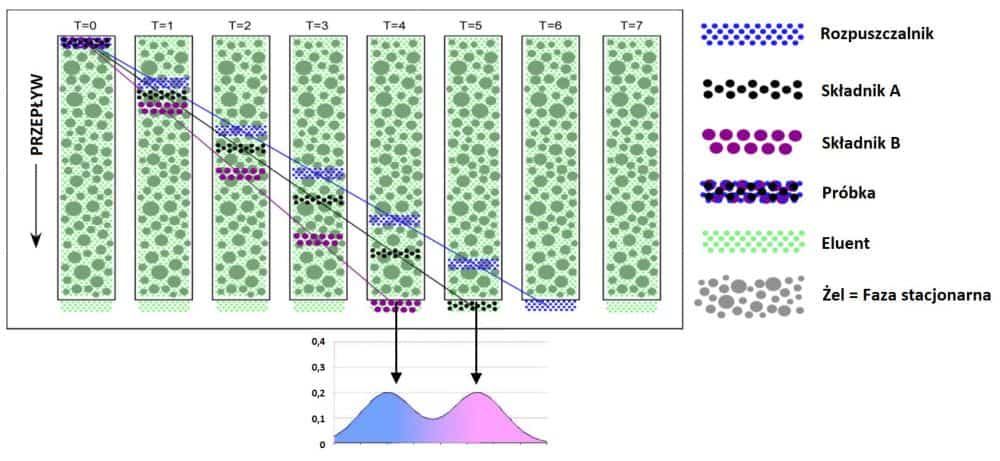
Rys. 1. Analiza białek za pomocą chromatografii wykluczania. Większe cząstki (kolor fioletowy) szybciej przepływają przez fazę Stacjonarną (żel), z kolei mniejsze cząstki (kolor czarny) wolniej przepływają przez wypełnioną żelem kolumnę. Na powyższym wykresie widoczny jest rozkład masy cząsteczkowej molekuł (białek), które zostały rozdzielone na 2 frakcje.
Innowacyjną metodą zapewniającą wydajną separację i charakteryzację białek, polimerów i nanocząstek jest Field-Flow Fractionation. Instrumenty wykorzystujące tę technikę charakteryzują się niezwykle wysoką rozdzielczością, dzięki której pozwalają na separację białek, peptydów i polimerów od 103 do 1012 Da. W przeciwieństwie do GPC/SEC cząstki rozdzielane są w otwartym kanale przepływu bez obecności fazy stacjonarnej. W tej technice, odwrotnie niż z chromatografii wykluczania, duże cząstki trafiają na detektor jako ostatnie. Analizatory wykorzystujące technikę FFF podobnie jak chromatografy żelowe kompatybilne są z szeregiem detektorów: stężeniowych (RI, UV lub RI/UV), statycznego rozpraszania światła (MALS) czy dynamicznego rozpraszania światła (DLS).
2. Analiza rozmiaru białek
Podstawową techniką służącą do analizy wielkości cząstek białek jest dynamiczne rozpraszanie światła (DLS). DLS zakłada, że zawieszone w cieczy cząstki poruszają się ruchami Browna z prędkością zależną od ich wielkości (im mniejsze cząstki tym szybkość ich drgań jest wyższa). Próbka w trakcie pomiaru oświetlana jest laserem, którego światło zostaje rozproszone na cząstkach poruszających się ruchami Browna. Powoduje to zmiany intensywności światła w czasie zależne od współczynnika dyfuzji cząstek w badanym roztworze. Następnie, wykorzystując równanie Stokesa-Einsteina, z danych rejestrowanych przez detektor wyznaczana jest średnica hydrodynamiczna molekuł.
3. Agregacja i mobilność białek
Wnikliwa analiza białek jest szczególnie istotna w procesie produkcji biofarmaceutyków, a kluczowe znaczenie dla oceny formulacji, w tym jej stabilności, ma analiza procesu agregacji makromolekuł. Ze względu na to, że agregaty o wielkości od 100 nm do 1 μm są szczególnie interesujące z punktu widzenia immunogenności, a zatem bezpieczeństwa produktu, istotne jest oznaczanie parametrów stabilności tychże produktów. Obecnie uznaje się, że nie tylko sam ładunek cząstek, lecz także ruchliwość elektroforetyczna determinuje ich stabilność w roztworze. Parametrem, który w prosty sposób określa skłonność białek zdyspergowanych w roztworze do agregacji jest potencjał zeta, do pomiaru którego wykorzystuje się analizatory pracujące w oparciu o technikę elektroforetycznego rozpraszania światła (ELS). Pomiar potencjału zeta połączony z wyznaczaniem wielkości cząstek przy pomocy dynamicznego rozpraszania światła w prosty sposób umożliwia określenie stanu agregacji białek i biofarmaceutyków.
4. Analiza struktury i stabilności białek i związków aktywnych optycznie
Spektroskopia CD ma szeroki zakres zastosowań w wielu dziedzinach. Ponieważ konformacja białka jest wrażliwa na środowisko, np. temperaturę, pH lub obecność ligandów, CD może być wykorzystana do obserwacji, jak zmienia się struktura drugorzędowa lub trzeciorzędowa w zależności od warunków środowiskowych lub interakcji z innymi cząsteczkami. Strukturalne, kinetyczne i termodynamiczne informacje o makrocząsteczkach mogą być uzyskane dzięki spektroskopii CD.
- UV CD jest używany do badania struktury drugorzędowej i trzeciorzędowej białek, porównania zmian struktur wyższego rzędu (HOS – Higher Order Structure).
- Zwijanie/rozwijanie białek, stabilność (termiczna/chemiczna). Badane mogą być zarówno rozpuszczalne jak i membranowe białka.
- UV/Vis CD jest używany do badania przejść ładunkowych.
- CD w bliskiej podczerwieni jest używany do badania struktury geometrycznej i elektronicznej poprzez sondowanie przejść orbitali metali.
- Wibracyjny dichroizm kołowy, który wykorzystuje światło z podczerwonego obszaru energetycznego, jest używany do badań strukturalnych małych cząsteczek organicznych, a ostatnio białek i DNA.
Urządzeniem umożliwiającym wykonanie tego typu analiz z zachowaniem wysokiej jakości i czułości danych jest Spektrometr CD Chirascan, brytyjskiej firmy Applied Photophysics.
5. Analiza stabilności termicznej białek, a także wiązań białek z innymi mikrocząsteczkami
Wśród technik pomiarowych wykorzystywanych do analizy stabilności termicznej białek można wyróżnić różnicową kalorymetrię skaningową. DSC (Differential Scanning Calorimetry) pozwala określić ciepło (energię) jakie musi być dostarczone do rozwinięcia natywnej formy białka, a także wyznaczyć zmianę pojemności cieplnej między formą natywną a zdenaturowaną. Wyznaczanie temperatury topnienia za pomocą mikrokalorymetrii DSC pozwala na określenie stabilności molekuły.
Techniką wykorzystywaną do analizy wiązań białek z innymi mikrocząsteczkami jest izotermiczna kalorymetria miareczkowa. ITC (Isothermal Titration Calorimetry) pozwala określić rodzaj i charakter wiązania, a także określić jak silne jest to wiązanie (entalpia i entropia) w danej temperaturze.
Stabilność białek zarówno termiczną jak i chemiczną można określić za pomocą techniki DSF (Differential Scanning Calorimetry), której podstawą jest analiza fluorescencji wewnętrznej białek.
Pomiar opiera się na rejestracji fluorescencji wewnętrznej badanego białka. Jako promieniowanie wzbudzające stosuje się światło LED w zakresie UV. Bezpośrednio na płytce, skanowanej z szybkością 1 °C/min, odczytywana jest zmiana wewnętrznej fluorescencji białka podczas jego rozwijania. Zmiany strukturalne biopolimeru wywoływane są narastaniem termicznym bądź izotermiczną denaturacją, zależnie od wykonywanego eksperymentu. Na podstawie otrzymanych danych można uzyskać parametry charakteryzujące stabilność białek, jak temperatura topnienia, zmiana energii swobodnej Gibbsa czy entalpii.
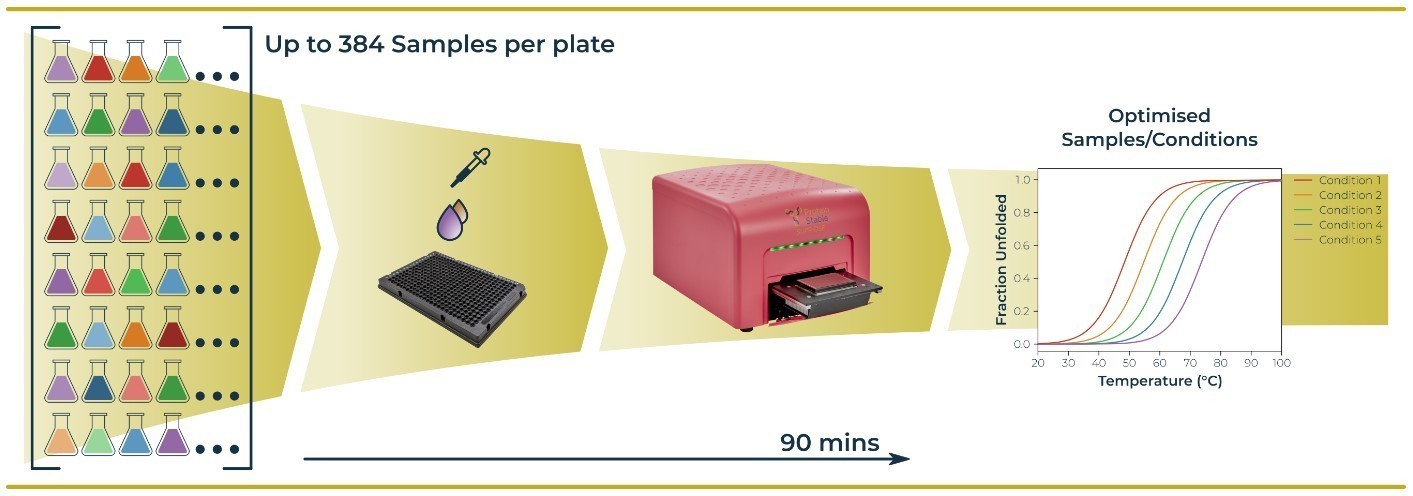
Rys. 2. Schemat pomiaru za pomocą analizatora DSF.
Techniką uzupełniającą pomiar ITC jest natomiast GCI (Grating – Coupled Interferometry). Jest to potężne narzędzie do badania interakcji biomolekularnych. Jest to biosensor optyczny, który wykorzystuje siatkę dyfrakcyjną do sprzężenia światła padającego w fale powierzchniowe. Te fale powierzchniowe, znane jako fale plazmonowe, mogą być używane do pomiaru zmian wskaźnika załamania ośrodka otaczającego.
GCI jest szczególnie przydatne do badania interakcji molekularnych na powierzchniach, takich jak wiązanie białek z przeciwciałami lub adsorpcja małych cząsteczek na powierzchni. Monitorując zmiany fali powierzchniowych, GCI może dostarczyć informacji na temat kinetyki i termodynamiki interakcji molekularnych w czasie rzeczywistym.
Jedną z głównych zalet GCI jest jej czułość. Jest w stanie wykryć interakcje molekularne z rozdzielczością w skali pikogramów na milimetr kwadratowy. Ta wysoka czułość czyni GCI szczególnie przydatnym do badania interakcji o niskiej siłach wiązania, które są trudne do wykrycia za pomocą innych metod.
GCI jest również wszechstronne i może być stosowane z szerokim zakresem powierzchni i analitów. Może być używane do badania interakcji na powierzchniach planarnych, nanopartkach, a nawet pojedynczych komórkach. Ta wszechstronność czyni GCI atrakcyjnym narzędziem do badania szerokiego spektrum układów biologicznych.
Poniżej porównanie technologii biosensorów „Label – free”:
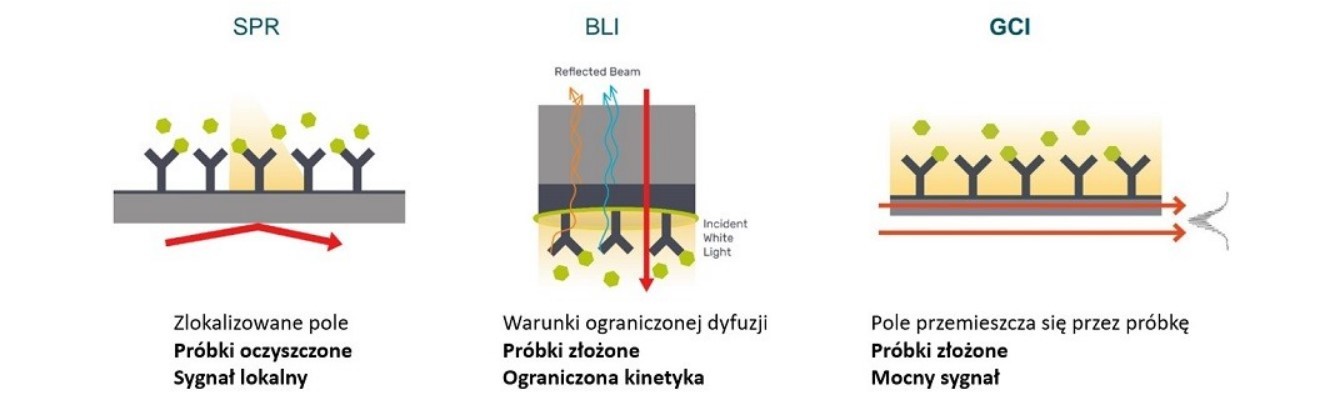
Rys. 3. Porównanie technologii biosensorów „Label – free”.
- SPR – detekcja oparta na zlokalizowanym obszarze
- BLI – technika oparta na warunkach ograniczonej dyfuzji ze względu na brak układu mikroprzepływowego
- GCI – większa powierzchnia detekcji = więcej przypadków wiązania, przyczyniających się do ogólnego zarejestrowanego sygnału = wyższa pierwotna czułość dla analizy interakcji „label – free”
Jedynym na rynku urządzeniem wykorzystującym opatentowaną technologię GCI jest system WAVEdelta szwajcarskiej firmy Creoptix (spółka należąca do Malvern Panalytical).
6. Analiza białek przy kontroli procesu produkcyjnego
Większość biofarmaceutyków wytwarzana jest z linii komórek ssaków. Dla uzyskania jak najlepszej jakości produktu konieczne jest dobranie odpowiednich parametrów bioreaktora. W trakcie samego procesu szczególnie istotne jest monitorowanie stężenia glukozy, które wpływa bezpośrednio na cykl metaboliczny komórek, ich rozmnażanie oraz produkcję metabolitów. Spektrometry Ramana umożliwiają pomiar stężenia glukozy w trybie ciągłym, a przez to optymalizację procesu produkcji biofarmaceutyków.
Instrumenty doskonale sprawdzają się także w monitorowaniu procesu oczyszczania białek. Zrozumienie procesu jest kluczowe, aby zapewnić najwyższą jakość produktu. Aktualne badania skupiają się na lepszym zrozumieniu etapów procesu, poprzez ilościowe pomiary kluczowych analitów, takich jak: aminokwasy, cukry i proteiny. Spektrometria Ramana pozwala na szybką i nieniszczącą analizę i ciągłą kontrolę.
Źródła:
malvernpanalytical.com

