W najnowszym artykule omówiliśmy charakterystykę wirusów AAV z wykorzystaniem przykładowych technik pomiarowych: MADLS, GPC/SEC, mikrokalorymetria DSC, ELISA – zapraszamy do lektury!
Zetasizer Ultra
Instrument Zetasizer Ultra jest zaawansowanym systemem rozpraszania światła (DLS, ang. Dynamic Light Scattering) wykorzystywanym do pomiaru wielkości, stabilności, ładunku czy stężenia nanocząstek i cząstek wirusowych. Pomiar wielkości cząstek wykonywany jest trzy razy szybciej w porównaniu z poprzednimi modelami rodziny Zetasizer. Wykorzystanie nowych metod analizy danych, tzw. Adaptive Correlation, gwarantuje precyzyjność, powtarzalność wyników oraz większą tolerancję dużych, obcych agregatów. Ponadto instrument wykorzystuje tzw. wielokątowe dynamiczne rozpraszanie światła (MADLS, ang. Multi-angle dynamic light scattering), co pozwala na pomiar stężenia badanych cząstek.
Technika DLS może być wykorzystywana do badań wirusów w celu wyznaczenia parametrów biofizycznych próbki lub, przy pomocy obrazowania, oddzielenia stabilnych elementów od tych skażonych czy agregujących. Zetasizer Ultra wyposażony w system MADLS umożliwia wyznaczenie nie tylko średnicy hydrodynamicznej i rozkładu wielkości cząstek badanej substancji, ale także stężenia danych populacji w próbce, w przeciągu kilku minut.
Pomiar wielkości i stężenia cząstek wirusów AAV techniką MADLS
Badaniu poddano trzy próbki zawierające cząsteczki wirusa AAV z wykorzystaniem instrumentu Zetasizer Ultra. Otrzymane dane w wyniku pomiaru stężenia porównano z wynikami pomiaru miana wirusa uzyskanymi dla tego kapsydu z testu ELISA.
Stosując technikę MADLS wykonano trzykrotnie pomiar rozkładu wielkości cząstek dla próbek AAV (Rys. 2). Zaobserwowano niski poziom agregatów w próbkach: w większym stopniu w próbce A będącej materiałem referencyjnym, niż we właściwych próbkach B i C. Wykorzystując nowe metody pomiaru stężenia, unikalne dla aparatu Zetasizer Ultra zintegrowane z systemem MALDS, zmierzono również stężenie cząstek AAV każdego agregatu (D-F). Otrzymane dane porównano z wynikami testu ELISA dla tegoż wirusa (Tabela 1), gdzie współczynnik RSD wyniósł mniej niż 15% dla próbek zawierających AVV i 45% dla materiału referencyjnego.
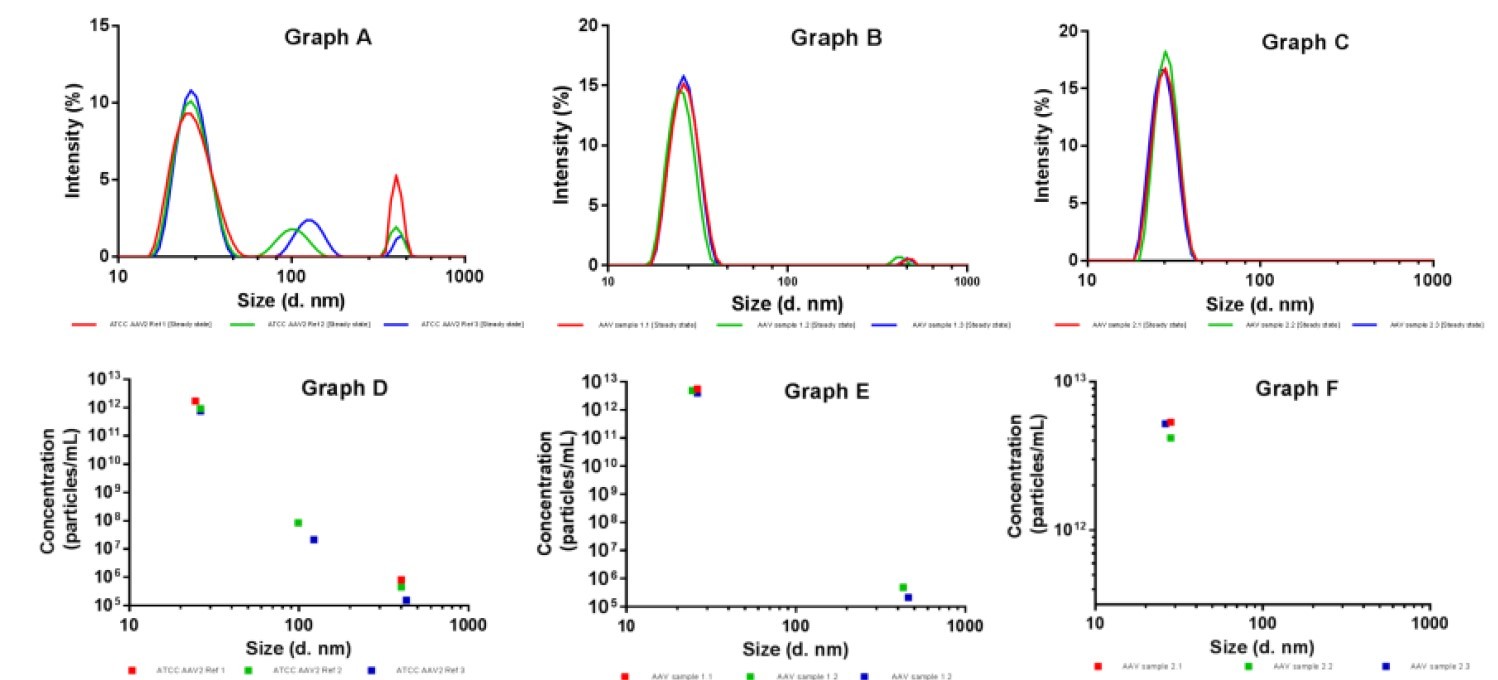
Rys. 2. Rozkład cząsteczek uzyskany dla próbek: A) ATCC AAV2 materiał referencyjny; B) pierwsza próbka AAV; C) druga próbka AAV. Stężenia cząsteczek poszczególnych próbek (D-E) odpowiadają powyższym widmom (A-C).
Pomiar ELISA
Jak napisano powyżej pomiar stężenia cząstek AAV przy pomocy Zetasizer Ultra zestawiono z wynikami testu ELISA dla tegoż wirusa. Wyniki dla monodyspersyjnych próbek rAAV (RSD 13-15%) odbiegają od oczekiwanych wartości miana wirusa otrzymanych z testu ELISA. Dla próbek zawierających agregaty obserwuje się wzrost współczynnika RSD do 45% ze względu na spadek dokładności wymiarowania próbki polidyspersyjnej.

Tabela 1. Wyniki pomiaru stężenia metodą ELISA oraz techniką MADLS dla trzech próbek; ATCC AAV2 próbka referencyjna, Próbka 1 i Próbka 2. Stężenia podane są w liczbie cząstek/ml.
Badanie cech wirusów AAV – OMNISEC
System OMNISEC wykorzystuje technikę chromatografii wykluczenia (SEC, ang. Size exclusion chromatography) w celu wyznaczenia parametrów opisujących cząsteczki wirusa AAV, takich jak miano kapsydu, bezwzględna masa cząsteczkowa, czy rozkład agregatów, oligomerów itp.
W badaniu wykonanym przez Malvern Panalytical na cząsteczkach AAV uzyskanych od Virovek obserwowano roztwory pustego i pełnego kapsydu wirusa rAAV. Masa molowa próbki pełnego kapsydu wyniosła 4,49 x 106 g/mol, frakcja białka 86%, masa molowa ssDNA 6,13 x 105 g/mol, a całkowite miano 7,48 x 1013 (monomery i agregaty). Masa molowa pustego rAAVs wyniosła 3,84 x 106 g/mol i całkowite miano 5,91 x 1013 (monomery i agregaty).
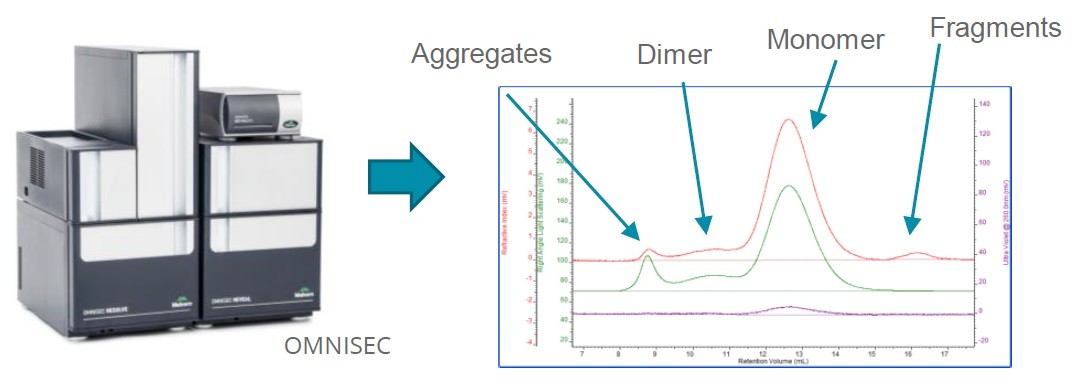
Rys. 3. Instrument OMNISEC i przykładowy chromatogram dla próbki zmieszanych monomerów, dimerów, agregatów i innych fragmentów pustego rAAV.
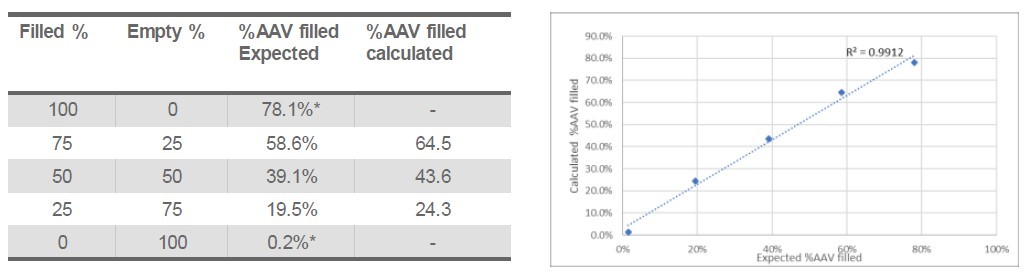
Rys. 4. Analiza procentowa zmieszanych próbek pełnego i pustego kapsydu rAAVs wykonana za pomocą systemu OMNISEC.
Charakterystyka wirusów AAV z wykorzystaniem mikrokalorymetru MicroCal PEAQ-DSC
Zautomatyzowany system MicroCal PEAQ-DSC wykorzystuje różnicową kalorymetrię skaningową do pomiaru białek, kwasów nukleinowych, a także stabilność i rozwijanie termiczne kapsydu wirusowego. Technika pozwala na wyznaczenie entalpii (∆H) i temperatury (Tm) zmian strukturalnych molekuł w roztworach indukowanych wzrostem lub spadkiem temperatury. Pomiar jest bezpośredni, nie wymaga etykiet, znaczników fluorescencyjnych ani wychwytywania przeciwciał.
Dane uzyskane w wyniku pomiaru z wykorzystaniem PEAQ-DSC dla próbek zawierających puste i pełne kapsydy rAAV5 ukazują wiele punktów, w których zachodzą zmiany strukturalne (Tm) związane z dezintegracją kapsydu (Tm1) oraz topnieniem ssDNA (Tm2). Ponadto w przypadku pełnej próbki obserwuje się niewielki sygnał przy 50 °C, w przeciwieństwie do pustego kapsydu rAAVs.

Rys. 5. Mikrokalorymetr PEAQ-DSC i przykładowy termogram DSC dla próbki pełnego kapsydu rAAV przedstawiający dwa punkty, w których zachodzi przemiana strukturalna – 89 i 94 °C. Czerwona gwiazdka oznacza sygnał pochodzący od niewielkiej przemiany w 50 °C.
Podsumowanie
- Współczynnik powtarzalności RSD równy 15% lub mniej, zaobserwowano dla pomiaru miana za pomocą testu ELISA i pomiaru stężenia wykorzystując instrument Zetasizer Ultra. Współczynnik RSD wyniósł 45% dla standardowej próbki zawierającej więcej agregatów.
- Czystość, rozkład oligomerów oraz % pełnych i pustych kapsydów rAAV wyznaczono za pomocą instrumentu OMNISEC wykorzystującego technikę chromatografii wykluczenia.
- Zmiany strukturalne wywołane zmianą temperatury oraz stabilność zmierzono dla próbek pustego i pełnego kapsydu rAAVs stosując system PEAQ-DSC.
Tabela 2. Charakterystyka wirusów AAV. Parametry próbki oraz techniki pomiarowe, którymi można je wyznaczyć.

Polecamy również obejrzeć webinar webinar naszego partnera Malvern Panalytical – „Understanding AAVs – Discover how multi-detection SEC improves sample characterization„, który odbył się 29 listopada 2022.
Źródła:
Jonathan G. Mehtala, Natalia Markova, John Stenson – Delivering Deeper into AAV attributes: enhanced characterization using multiple technologies, Malvern Panalytical poster.


